【科普】| 肠道菌群与高压氧治疗
2025-05-09 15:16
高压氧治疗最初用于治疗潜水员的减压病,特别是缓解氮气气泡引起的关节疼痛。高压氧治疗需要在增加的大气压(通常为海平面标准压力的2-3倍,即2.0-3.0ATA)下吸入100%氧气。此过程可减轻组织水肿,并为在正常大气压下无法充分氧合的组织提供充足氧气。在2-3ATA氧压下,动脉氧水平超过2000mmHg,组织氧浓度可达约400mmHg。血浆中压力与氧浓度的增加能够向缺氧组织输送更多氧气,促进组织愈合
高压氧治疗在急性和慢性炎症中均显示出多重有益通路。例如,它可抑制炎性细胞因子生成、增强生长因子合成、促进骨髓干细胞迁移,从而改善伤口愈合。高压氧治疗的适应症已从最初的减压病和动脉气体栓塞“扩展至多个领域,包括治疗骨髓炎:(促进伤口愈合和血管生成)、软组织感染、放疗并发症、一氧化碳和氰化物中毒“等毒理学疾病,以及脑卒中。
高压氧治疗在减压病、放射性直肠炎和-氧化碳中毒等特定疾病的治疗中占据核心地位。其高安全性使其成为可与其他疗法轻松联用的辅助治疗手段。尽管可能因压力或氧毒性产生轻微短暂副作用(如中耳气压伤),高压氧治疗仍被视为相对安全的治疗方式
在胃肠病学领域,盆腔放疗后的慢性肠功能障碍被广泛认可为高压氧治疗的适应症。近期研究报道了高压氧治疗治疗炎症性肠病的疗效及其与肠道菌群的关联。一项基于多中心国际注册的队列研究显示,在9726例患者中12.4%(47/378)的溃疡性结肠炎患者和10.6%(40/378)的克罗恩病“患者接受了高压氧治疗
参考文献:Muroya D,Nadayoshi S, KaiY, et al. Gut microbiota and hyperbaricoxygen therapy. Med Gas Res.2025 Dec1;15(4):548-549.
高压氧和肠道菌群
肠道菌群被视为一种内分泌器官,能够影响远端器官及相关生物通路,其稳态对维持健康至关重要。肠道菌群失调被认为可通过免疫系统、内分泌系统和代谢通路影响多种疾病的发生与发展
高压氧治疗已知会影响肠道菌群,但具体机制尚不明确。由于高压氧环境可抑制厌氧菌感染,氧气供应可能影响生理性缺氧状态下的肠道厌氧菌。有假说认为高压氧治疗通过促进氧自由基(具有强氧化与杀菌作用)的生成,抑制需氧化代谢细菌的生长,并抑制控制细菌生长的质粒表达。此外,对健康个体的研究表明,单纯高压氧条件即可改变肠道菌群。尽管高压氧治疗对健康肠道的影响尚不明确,但多数报告显示其对菌群失调的肠道具有积极临床效果。由于肠道菌群与免疫、内分泌及代谢等多条通路相关,高压氧治疗改善菌群失调的确切机制仍有待阐明。成人肠道菌群90%以上由厚壁菌门、拟杆菌门、放线菌门和变形菌门组成。结肠主要由代谢最活跃的厌氧菌群主导,包括厚壁菌门、拟杆菌门、疣微菌门等。菌群失衡与炎症性肠病相关,但机制尚未明确-项孟德尔随机化分析研究报道,疣微菌科、阿克曼菌属和Dorea属可能与炎症性肠病存在因果关系。炎症性肠病患者中,毛螺菌科减少和丁酸盐水平降低已被观察到。阿克曼菌属是肠道共生菌,可能具有抗炎特性,但其水平在炎症性肠病患者中往往较低。为维持菌群稳态,益生菌、益生元补充和粪菌移植是常用疗法而高压氧治疗可被视为这些疗法的潜在补充。我们关注高压氧治疗改善菌群失调的能力,并报道了其在治疗艰难梭菌相关性结肠炎中的有效性。近期研究还表明高压氧治疗对创伤性脑损伤后的肠道功能障碍具有疗效。因此,未来研究应重点探索高压氧治疗在菌群失调相关疾病中的疗效。
01、高压氧治疗炎症性肠病
高压氧治疗的疗效已在炎症性肠病全谱系(包括溃疡性结肠炎、克罗恩病及接受回肠储袋肛管吻合术的患者)中得到报道。它可降低重度溃疡性结肠炎活动性提高缓解率、减少住院期间结肠切除需求。此外,47%的结肠切除术后接受储袋手术的患者会发生储袋炎a而高压氧治疗可有效改善储袋炎。在克罗恩病中,肛周瘘管管理尤为困难,但高压氧治疗作为辅助疗法在克罗恩病合并肛周瘘管及肠外表现患者中显示出前景。一项系统性综述和荟萃分析(纳入19项研究,含3项随机对照试验)对809例患者进行分析,报道的临床缓解率为:溃疡性结肠炎 87%、克罗恩病肠道病变88%、克罗恩病肛周病变60%。目前,美国国立卫生研究院(NIH)与国家糖尿病、消化和肾脏疾病-研究所(NIDDK)正计划开展一项大型多中心随机对照试验。
02、高压氧治疗机制
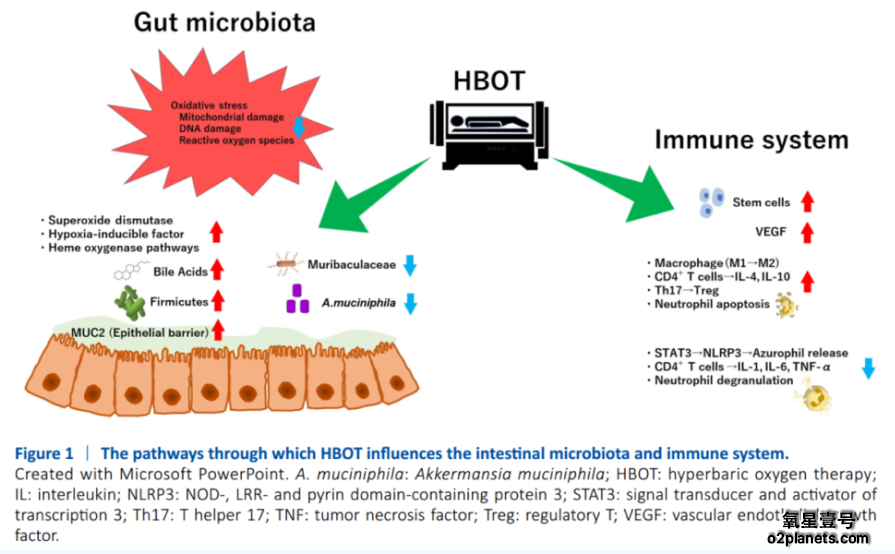
主要通过增强氧供应和减轻炎症缓解肠道氧化应激。炎症性肠病中微血管损伤导致黏膜缺氧,加剧氧化应激与炎症。高压氧治疗通过将氧气直接溶解于血浆,绕过受损血管,改善组织氧合。氧合增强可减少缺氧诱导的活性氧(ROS)生成,缓解线粒体功能障碍,打破氧化应激与炎症的恶性循环。此外,高压氧治疗可增强抗氧化酶活性,减少肠上皮细胞的氧化损伤。通过稳定肠道屏障和调节免疫反应高压氧治疗促进黏膜愈合并减轻炎症性肠病的慢性炎症。高压氧治疗还可减少炎性细胞因子(IL-1、IL-6、TNF-a)的生成,抑制中性粒细胞黏附,并通过一氧化氮和血管内皮生长因子(VEGF)信号通路上调缺氧诱导因子(HIF)和血红素氧合酶(HO)等缺氧耐受通路
高压氧治疗在改善溃疡性结肠炎和克罗恩病患者肠道菌群失调方面展现出潜力。菌群失调的特征是严格厌氧菌减少兼性厌氧菌增多,这在炎症性肠病发病机制中起关键作用。高压氧治疗通过增加肠黏膜至肠腔的氧输送,不仅直接改变菌群组成,还可通过调节宿主免疫系统促进菌群重构。
蛋白质组学分析与数字空间谱显示高压氧治疗可抑制中性粒细胞脱颗粒,特异性减少嗜天青颗粒相关蛋白。此作用与通过STAT3信号通路调控NLRP3症小体以抑制炎症相关。此外,高压氧治疗可减少活性氧和MAPK信号,同时促进中性粒细胞凋亡,从而抑制炎性介质释放,并增加促凋亡蛋自BIM和抗凋亡蛋自BCL-XL水平,实现炎症反应的调控
高压氧治疗还会显著改变肠道菌群组成。其影响可能通过抑制黏蛋白降解菌(如毛螺菌科和阿克曼菌科)导致香农多样性下降,从而使厚壁菌门比例增加并升高胆汁酸水平。:最简假说为:高压氧治疗诱导的氧供应抑制了严格厌氧的毛螺菌科和阿克曼菌科,与导致兼性厌氧的厚壁菌门相对增加。
MUC2是肠道内黏液层的核心结构蛋白,其屏障功能减弱被认为是溃疡性结肠炎患者和动物模型中菌群失调的早期事件。这种MUC2缺陷相关失调的特征是厚壁菌门减少、毛螺菌科和阿克曼菌科增多,与上述假说一致。然而存在矛盾结论:毛螺菌科可通过多糖代谢产生短链脂肪酸刺激黏液分泌,激活信号通路并发挥抗炎作用。而炎症性肠病患者中毛螺菌科减少也被观察到。
炎症性肠病的菌群失调主要表现为严格厌氧菌减少和兼性厌氧菌增多,部分研究提示毛螺菌科丰度下降与疾病发病直接相关。综上,仅凭菌群变化无法完全解释高压氧治疗通过增加肠腔氧浓度改善失调的机制。因此,需进一步研究并谨慎解读高压氧治疗对肠道菌群失调的影响。动物模型中,高压氧治疗引起的菌群变化可通过直接作用于宿主中性粒细胞STAT3通路减轻结肠炎,从而改善疾病活动度,
结论:高压氧治疗已应用于多种疾病,因其安全性可轻松与现有疗法联用是一种有前景的辅助治疗。在胃肠病学领域,其通过改善黏液层、胆汁酸代谢和调节菌群等多重机制对炎症性肠病的疗效已被报道。然而,关于高压氧治疗纠正菌群失调的研究中,厚壁菌门与阿克曼菌利(尤其是阿克曼菌)的结果存在矛盾,需进一步研究与谨慎解读。
文章来源:仁怡高压氧公众号
作者: 宋祥胜
(转载仅作科普,如有侵权请联系删除,谢谢。)


